Corcept Therapeutics Incorporated (NASDAQ : CORT), une société de phase commerciale engagée dans la découverte et le développement de médicaments pour traiter les troubles endocrinologiques, oncologiques, métaboliques et neurologiques graves en modulant les effets de l'hormone cortisol, a présenté les résultats de son étude DAZALS sur le dazucorilant chez les patients atteints de SLA lors de la réunion annuelle 2025 du Réseau européen pour guérir la SLA (ENCALS). La présentation est disponible ici.
Ce communiqué de presse contient des éléments multimédias. Voir le communiqué complet ici : https://www.businesswire.com/news/home/20250605200706/fr/
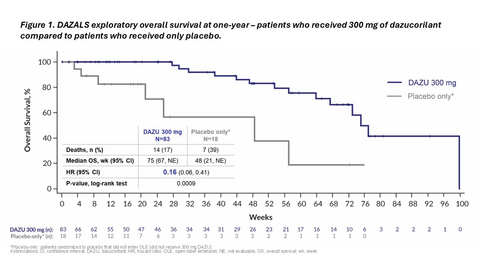
Figure 1. DAZALS exploratory overall survival analysis at one-year – patients who received 300 mg of dazucorilant compared to patients who received only placebo.
DAZALS est une étude de phase 2 randomisée, en double aveugle, contrôlée par placebo, dans laquelle 249 patients atteints de SLA ont été randomisés pour recevoir soit 150 mg de dazucorilant, 300 mg de dazucorilant ou un placebo, par jour pendant 24 semaines. Les patients qui ont terminé la période de traitement étaient éligibles pour participer à une étude d'extension à long terme dans laquelle tous les patients ont reçu 300 mg de dazucorilant. Le critère principal dans DAZALS était la différence dans ALSFRS-R entre les patients qui ont reçu dazucorilant et ceux qui ont reçu le placebo. La survie globale était un critère secondaire.
Bien que DAZALS n'ait pas atteint son critère principal, la survie du patient s'est considérablement améliorée. À la semaine 24 de l'étude, aucun décès n'est survenu chez les 83 patients ayant reçu 300 mg de dazucorilant, contre cinq décès dans le groupe placebo de 82 patients (valeur p 0,02).
Une analyse exploratoire à un an montre que l'avantage de survie s'est poursuivi. Les patients randomisés à 300 mg de dazucorilant ont vécu significativement plus longtemps que les patients ayant reçu le placebo et qui ne sont pas passés à 300 mg de dazucorilant dans l'étude d'extension. La différence entre les groupes était prononcée, avec un rapport de risque de 0,16 (valeur p 0,0009). Voir Figure 1.
Un bénéfice de survie similaire a été observé chez les patients ayant reçu 300 mg de dazucorilant pendant plus de 24 semaines, soit au cours de la période de traitement, soit dans l'étude d'extension, par rapport aux patients ayant reçu soit un placebo, soit 150 mg de dazucorilant pendant 24 semaines et n'ayant pas reçu de dazucorilant dans l'étude d'extension (rapport de risque : 0,36 ; valeur p 0,02).Voir Figure 2. L'étude d'extension est en cours.
Le dazucorilant a démontré un profil d'innocuité acceptable, 92 % des événements indésirables étant d'intensité légère à modérée. La fréquence des événements indésirables graves et sévères chez les patients ayant reçu du dazucorilant était similaire à celle des patients ayant reçu le placebo. Légère à modérée, la douleur abdominale transitoire liée à la dose était l'effet indésirable le plus courant.
« L’amélioration de la survie globale, constatée pour la première fois dans l’étude DAZALS à six mois, continue d’être observée à un an. Ce résultat mérite toute notre attention pour les patients atteints de cette maladie tragique. Les progrès dans le développement de nouveaux traitements contre la SLA sont d’une importance cruciale », déclare Leonard H. van den Berg, M.D., Ph.D., professeur et président du service de neurologie, UMC Utrecht Brain Centre, Utrecht, Pays-Bas, et chercheur principal dans l’étude DAZALS.
« Des médicaments susceptibles de prolonger la vie des patients atteints de SLA sont nécessaires de toute urgence. Nous travaillons avec les autorités de régulation pour déterminer la voie optimale pour faire progresser le dazucorilant », déclare Bill Guyer, PharmD, directeur du développement de Corcept. « Nous tenons à remercier les patients, leurs familles et leurs partenaires de soins, ainsi que les enquêteurs, les médecins et le personnel de la clinique participant à cette étude. »
À propos de l'étude DAZALS
DAZALS est un essai randomisé, en double aveugle, contrôlé contre placebo de phase 2 dans lequel 249 patients atteints de SLA ont été randomisés 1:1:1 pour recevoir soit 150 mg de dazucorilant, 300 mg de dazucorilant ou un placebo par jour pendant 24 semaines. Les patients qui ont terminé la période de traitement étaient éligibles pour participer à l'étude d'extension à long terme dans laquelle tous les patients ont reçu 300 mg de dazucorilant. Les caractéristiques de référence des patients, y compris le score de risque ENCALS, le temps écoulé depuis le diagnostic, le score total ALSFRS-R et le début de la phase bulbaire, étaient cohérentes dans tous les groupes de l'étude.
Le critère d’évaluation primaire de DAZALS était la différence de variation par rapport au niveau de référence au cours de la période de traitement de 24 semaines de l’étude dans le score ALSFRS-R entre les patients ayant reçu du dazucorilant et ceux ayant reçu un placebo. Les critères secondaires comprennent la survie globale et la qualité de vie. DAZALS a été réalisé en Europe, aux États-Unis et au Canada.
À propos de la sclérose latérale amyotrophique (SLA)
Également connue sous le nom de maladie de Lou Gehrig ou maladie des motoneurones, la SLA est un trouble neurologique dégénératif mortel qui touche plus de 55 000 personnes aux États-Unis et en Europe. La SLA affaiblit les muscles et, à mesure que la maladie progresse, elle nuit gravement à la capacité des patients à parler, à manger, à bouger et à respirer. Il existe de plus en plus de preuves que les patients atteints de SLA, en particulier ceux présentant une progression rapide de la maladie, présentent des taux de cortisol élevés ou anormaux. L’espérance de vie d’un patient après le diagnostic est de deux à cinq ans.
À propos du dazucorilant
Le dazucorilant est un modulateur sélectif du cortisol qui se lie au récepteur des glucocorticoïdes mais ne se lie pas aux autres récepteurs hormonaux de l’organisme. Corcept l'étudie comme traitement potentiel de la SLA et d'autres troubles neurologiques. Le dazucorilant est détenu par Corcept et est protégé par la composition de la matière, la méthode d'utilisation et d'autres brevets. La Food and Drug Administration des États-Unis a accordé la désignation Fast Track et le statut de médicament orphelin au dazucorilant pour le traitement de la SLA aux États-Unis.
À propos de Corcept Therapeutics
Depuis plus de 25 ans, Corcept se concentre sur la modulation du cortisol et son potentiel pour traiter les patients atteints d'une grande variété de troubles graves et a découvert plus de 1 000 modulateurs sélectifs du cortisol et antagonistes des récepteurs des glucocorticoïdes. Corcept mène des essais cliniques avancés chez des patients atteints d'hypercortisolisme, de tumeurs solides, de SLA et de maladie du foie. En février 2012, la société a lancé Korlym®, le premier médicament approuvé par la Food and Drug Administration des États-Unis pour le traitement des patients atteints d'hypercortisolisme endogène. Corcept a son siège social à Redwood City, en Californie. Pour plus d'informations, visitez Corcept.com.
Déclarations prospectives
Les déclarations contenues dans le présent communiqué de presse, autres que les déclarations de faits historiques, sont des déclarations prospectives fondées sur nos plans et nos attentes actuels, qui sont assujettis à des risques et à des incertitudes susceptibles de faire en sorte que nos résultats réels diffèrent sensiblement de ceux que ces déclarations expriment ou impliquent. Ces risques et incertitudes sont exposés dans nos documents déposés auprès de la SEC, qui sont disponibles sur notre site web et sur le site web de la SEC.
Dans ce communiqué de presse, les déclarations prospectives incluent celles concernant le développement du dazucorilant en tant que traitement pour les patients atteints de SLA, y compris le rythme, la gestion, le calendrier et les résultats de DAZALS et de son étude d'extension à long terme associée, ainsi que la surveillance ou les exigences qui peuvent être imposées par la FDA ou d'autres autorités réglementaires. Nous déclinons toute intention ou obligation de mettre à jour les déclarations prospectives faites dans ce communiqué de presse.
Le texte du communiqué issu d’une traduction ne doit d’aucune manière être considéré comme officiel. La seule version du communiqué qui fasse foi est celle du communiqué dans sa langue d’origine. La traduction devra toujours être confrontée au texte source, qui fera jurisprudence.
Consultez la version source sur businesswire.com : https://www.businesswire.com/news/home/20250605200706/fr/
© Business Wire, Inc.
Avertissement :
Ce communiqué de presse n’est pas un document produit par l’AFP. L’AFP décline toute responsabilité quant à son contenu. Pour toute question le concernant, veuillez contacter les personnes/entités indiquées dans le corps du communiqué de presse.
